環境中殘留的抗生素及其引起的耐藥基因傳播�,給人類健康帶來危害���。在眾多種類抗生素中�,β-內酰胺類抗生素(如青霉素、阿莫西林、頭孢氨芐等)用量占比約為70%���。目前常用的生物降解方法處理效率因抗生素分子本身固有的抗菌活性而降低。β-內酰胺類抗生素的生物活性主要來源于β-內酰胺四元環,其開環產物的毒性和可生化性均得到改善。如何實現β-內酰胺四元環的經濟����、高效開環是亟待解決的難題���。高級氧化技術可以徹底氧化分解抗生素分子����,但其產生的羥基自由基等活性物種一般沒有選擇性�,會被水中共存的其他溶解性有機/無機物(>mg/L)截獲,導致殘留的微量抗生素(mg-ng/L)難以經濟且有效的去除。
中國科學院化學研究所光化學院重點實驗室研究員馬萬紅及合作者發現����,過渡金屬離子錨定在共價有機框架材料(COFs)上制備的Lewis酸復合光催化劑���,在可見光光照射下可高效����、高選擇性光-熱催化β-內酰胺類抗生素分子水解開環并完全脫羧���。與傳統的氧化礦化為主的降解路徑不同���,該催化體系有效避免了水中共存溶解性有機/無機物的干擾�,水解產物可生化性顯著提高���,可通過傳統生化處理技術有效去除����。?
過渡金屬離子如Cu2+、Zn2+作為一類常見的均相Lewis酸催化劑���,可催化酰胺鍵、酯鍵的水解反應����,但常溫下水解效率低�,在實際運行中很難通過加熱龐大的污/廢水體系來實現消除微量(mg-ng/L)抗生素污染物���。該團隊發現將Cu2+錨定在帶有聯吡啶linker的COF材料上����,既可保證Cu2+的Lewis酸的催化特性,又拓展了COFs材料在可見光區的光熱轉化效應����,將有限的熱能最大限度地集中在Cu2+催化位點上����,能夠在1分鐘內將Cu2+位點局域加熱到211℃以上(氣/固介質)����。該體系在常溫水介質中可將催化位點的局域溫度升高到60℃,提高了β-內酰胺鍵催化水解速率���。10分鐘內的光照即可完成幾乎所有的β-內酰胺類抗生素的水解開環,速率比暗反應提高了24倍���。與傳統的均相Lewis酸催化相比,該體系的水解產物是全脫羧的����,具有更低的致畸���、致癌以及內分泌干擾等毒性����。在共存各種溶解性有機/無機物的水中降解殘留抗生素實驗表明�,Cu2+/COF光熱催化劑可實現抗生素的選擇性降解,而傳統的高級氧化技術如TiO2光催化���、O3氧化和Fenton降解方法,由于產生的活性物種不具備選擇性����,在同樣條件下均無法實現目標抗生素降解���。
相關研究成果發表在《美國國家科學院院刊》(PNAS)上����。美國化學會C&EN以One-two punch degrades antibiotics in wastewater為題報道了這一成果���。該研究由化學所和北京工商大學合作完成�。研究工作得到國家自然科學基金委員會����、科學技術部和中國科學院的支持。?
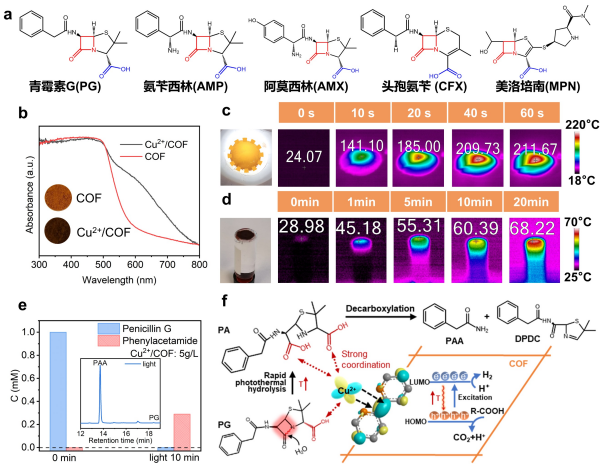
(a)常見β-內酰胺類抗生素結構式�。(b)COF和Cu2+/COF的固體紫外-可見吸收光譜���。(c)(d)為Cu2+/COF在氣/固介質和水介質中在模擬太陽光光照下的紅外熱像圖�。(e)Cu2+/COF 10分鐘完成光熱催化降解青霉素(PG)和水解產物(PAA)的生成����,內插圖為反應終止時產物PAA對應的HPLC圖。(f)Cu2+/COF光熱催化青霉素水解/全脫羧的機理示意圖。